ТРИВИМІРНА МОЛЕКУЛА
Коли я викладав в медичному інституті, мені завжди доводилося долати психологічні труднощі спілкування з норовливої аудиторією. Студенти прийшли вивчати медицину, їм не терпілося одягатися в білі халати, озброїтися стетоскопом, шпателем для отдавліваніі мови і блоком рецептів.
А замість цього з'ясувалося, що перші два роки (по крайней мере, так було за часів мого активного викладання) їм доведеться вивчати «фундаментальні науки». Тобто вони змушені слухати лекції, дуже схожі на ті, якими їх мучили в коледжі.
Деякі з фундаментальних наук хоча б мали явний зв'язок з медициною, який студенти її представляли, особливо анатомія, де вони із захопленням потрошили трупи. А от самій непотрібної, далі інших віддаленої від гри доктор - пацієнт, самої абстрактної і самої незрозумілої, до того ж викладається зневажаються докторами філософії була біохімія. І природно, саме біохімію я викладав.
Я випробував безліч способів, щоб подолати природне презирство студента-медика до біохімії. Найкраще спрацьовував (або, принаймні, приносив мені найбільше задоволення) натхненна розповідь про "найбільшого відкритті у всій історії медицини» - мікробної теорії хвороб. Коли обставини того вимагають, я можу виступити дуже яскраво і вознести відкриття і його наслідки на запаморочливу висоту.
А потім я зазвичай говорив: «Але ви, ймовірно, вважаєте само собою зрозумілим, що жоден фізик не міг зробити таку круту ломку в медицині. Першовідкривачем був Луї Пастер, доктор філософії, біохімік ».
Однак перше велике відкриття Пастера не мало ніякого відношення до медицини і лежало в області чистої хімії. Йдеться про оптично активних речовинах - темі моєї попередньої глави. Щоб оцінити внесок Пастера, давайте почнемо з самого початку.
У виноробному процесі ферментації виноградного соку відділяється мулиста субстанція, звана tartar (винний камінь) - слово невідомого походження. У 1769 році шведський хімік Карл Вільгельм Шеєле виділив з винного каменю з'єднання з кислотними властивостями, яке, природно, назвав винною кислотою.
Само по собі це відкриття не було СУПЕРВАЖНО, але потім, в 1820 році, німецький виробник хімікатів Карл Кестнер виготовив щось, що, на його думку, повинно було бути винною кислотою і все ж такої не було, наприклад мало меншу розчинність. Зразки були послані декільком хімікам, які з цікавістю приступили до їх вивчення. В результаті французький хімік Жозеф Луї Гей-Люссак назвав цю речовину «виноградної кислотою» (racemic) від латинського слова, що означає «гроно (кисть) винограду».
Чим ретельніше вивчали винну і виноградну кислоти, тим більш дивними знаходили відмінності в їх властивості. Аналіз показав, що молекули обох кислот складаються з однакової кількості одних і тих самих атомів. Використовуючи сучасні символи, формулою і того і іншого речовини була C4H6O6.
На початку XIX століття, коли атомістичної теорії налічувалося близько чверті століття, хіміки вирішили, що кожна відмінна від інших молекула складається з різної кількості різних атомів, тобто фактично за різницю властивостей відповідає різний зміст атомів. І ось отримані два речовини з цілком помітними властивостями, але складаються з одного і того ж кількості одних і тих самих атомів. Дуже тривожне явище, особливо якщо врахувати, що про подібний повідомлялося не в перший раз.
У 1830 році непохитний шведський хімік Йенс Якоб Берцеліус 7 , Що не допускав можливості існування молекул з однаковою структурою, але з різними властивостями, детально дослідив і винну, і виноградну кислоту. З великим жалем йому довелося визнати, що, незважаючи на всі його невіра, подібне існує. Він змирився з неминучим і назвав речовини з однаковою структурою і різними властивостями «изомерами» від грецького слова, що означає «рівні кількісні співвідношення (пропорції)» елементів.
Але яким же чином ізомери, маючи один і той же атомний склад, все ж є різними речовинами? Може бути, важливо не тільки число атомів кожного елемента, але і їх фізичне розташування всередині молекули? Однак хіміки чомусь шарахалися від цієї думки. Вся вистава про атоми було дуже хитким. Атоми були корисні при поясненні хімічних властивостей, але їх неможливо було побачити або будь-яким чином виявити, так що вони цілком могли виявитися не більше ніж зручною фантазією. Завести розмову про розташування атомів в молекулах означало підійти до сприйняття атомів як реальних об'єктів, на що не наважувалася більшість хіміків.
Явище ізомерії, таким чином, залишилося непоясненим, і його залишили в спокої до тих пір, поки розвиток хімії не надасть пояснення.
Одна відмінність у властивостях винної і виноградної кислот викликало особливий інтерес. Розчин винної кислоти або її солей (тобто сполуки, в яких водень кислоти замінений атомом таких елементів, як натрій або калій) виявився оптично активним. Він повертав площину поляризованого світла за годинниковою стрілкою і, отже, був правовращающим (див. Попередню главу), так що з'єднання цілком можна було назвати d -він кислотою.
З іншого боку, розчин виноградної кислоти був оптично неактивним. Він не повертав площину поляризованого світла ні в яку сторону. Ця різниця у властивостях було наочно продемонстровано французьким хіміком Жаном Баптистом Біо, якого я згадував у попередньому розділі як першовідкривача науки поля-ріметріі.
У той час ніхто не знав, звідки береться оптична активність речовини в розчині, але все твердо знали наступне: кристали, що володіють оптичною активністю, мають асиметричну структуру. В цьому випадку, якщо кому-то треба було приготувати кристали винної кислоти і виноградної кислоти або, відповідно, їх солей, обов'язково виявлялося, що кристали першої асиметричні, а кристали другий симетричні.
Однак в 1844 році німецький хімік Ейльгард Мічерліх провів наступне дослідження. Він сформував кристали калієво-натрієвої солі (sodium ammonium salt) винної і виноградної кислот, ретельно їх вивчив і оголосив, що обидві речовини є абсолютно ідентичними кристалами.
Це повідомлення рознесло в пух і прах базові відкриття багатообіцяючої науки поляриметрії і привело всіх у сум'яття.
Саме в цей момент на наукову сцену вийшов молодий французький хімік Луї Пастер. Йому було трохи більше двадцяти років, і вчився він дуже середньо, однак йому вистачило сміливості припустити, що Мічерліх (один з провідних хіміків) помилився. Зрештою досліджувані ним кристали були маленькими, і, можливо, він упустив дрібні деталі.
Пастер приступив до справи і почав створювати кристали і ретельно вивчати їх через збільшувальне скло. Врешті-решт він вирішив, що в кристалах калієво-натрієвої солі винної кислоти є певна асиметрія. Поки все йшло добре. Цього, щонайменше, очікували, оскільки речовина була оптично активним.
Але чи можливо, що калієво-натрієва сіль виноградної кислоти формує точно такі ж кристали, які створював Мічерліх? Тоді вийшли б асиметричні кристали оптично активної речовини, що викликало сильну тривогу.
Пастер отримав і вивчив кристали солі виноградної кислоти і виявив, що вони дійсно є асиметричними, але не всі кристали ідентичні.
Деякі кристали дійсно були в точності такими ж, як кристали калієво-натрієвої солі винної кислоти, але інші були дзеркальними відображеннями першої групи і мали асиметрію протилежного змісту.
Чи могла виноградна кислота наполовину бути винною кислотою, а наполовину її дзеркальним відображенням? І стало бути, причина оптично-активності виноградної кислоти полягає в тому, що вона складається з двох частин і одна частина нейтралізує вплив іншої?
Це слід було досконально перевірити. Озброївшись пінцетом, Пастер почав вивчати крихітні кристали солі виноградної кислоти. Все справа наліво кристали він відкладав в одну сторону; все лівосторонні - в іншу. Трудитися довелося довго, оскільки він не бажав помилитися, але в кінці кінців справа була зроблена.
Потім Пастер розчинив кожну купку кристалів в окремій посудині з водою і виявив, що обидва розчини оптично активні!
Один з розчинів був правовращающим, точно як винна кислота. Насправді це і була у всіх сенсах винна кислота.
Інший розчин був левовращающего і відрізнявся від винної кислоти тим, що обертав площину поляризованого світла в протилежному напрямку. Це була / -він кислота.
Пастер оголосив про результати своїх досліджень в 1848 році, коли йому було всього лише двадцять шість років. Він встановив, що виноградна кислота оптично неактивна тільки тому, що складається з рівних кількостей d -він і l -він кислот.
Це повідомлення викликало сенсацію, і Біо, великий батько поляриметрії, якому в той час було сімдесят чотири роки, завбачливо відмовився визнати відкриття Пастера. Тоді Пастер вирішив особисто продемонструвати експеримент патріарху.
Біо дав молодому вченому особисто їм випробувану порцію виноградної кислоти, в оптичній неактивності якої він був упевнений. Під пильним поглядом старого Біо, не бажав допустити шахрайства, Пастер отримав сіль, кристалізуватися її, виділив кристали і ретельно розділив їх за допомогою збільшувального скла і пінцета. Потім до справи взявся Біо. Він особисто підготував розчини з кожного сорту кристалів і помістив їх у поляриметр.
Ну звичайно, ви вже здогадалися. Біо виявив, що обидва розчини оптично активні і прямо протилежні одна одній. Після цього з типово гальським ентузіазмом він став фанатичним прихильником Пастера.
Насправді Пастера фантастично пощастило. При кристалізації калієво-натрієвої солі виноградної кислоти зовсім не обов'язково формуються окремі кристали - дзеркальні відображення. Цілком можуть сформуватися поєднання кристалів, в кожному з яких будуть рівні кількості молекул d -він і l -він кислот. Ці поєднання кристалів симетричні.
Якби Пастер отримав такі кристали, він все одно помітив би їх відміну від кристалів калієво-натрієвої солі винної кислоти і спростував би твердження Мічерліха. З іншого боку, він упустив би набагато більш велике відкриття причини оптичної неактивності виноградної кислоти і не став би першою людиною, який створив оптично активні речовини з оптично неактивних.
Так відбувається, що при температурах вище 28 градусів за Цельсієм (82 градусів за Фаренгейтом) з розчинів утворюються тільки симетрично комбіновані кристали. Щоб утворити окремі групи асиметричних кристалів, потрібні розчини калієво-натрієвої солі виноградної кислоти при температурах нижче 28 градусів за Цельсієм. Більш того, отримувані кристали зазвичай такі малі, що їх неможливо розділити під збільшувальним склом. Так вже вийшло, що Пастер працював при низьких температурах і в умовах, відповідних для формування досить великих кристалів.
Можна уявити Пастера звичайною людиною, що скористався несподіваною удачею, але (як я постійно розповідав своїм студентам) він примудрявся користуватися подібними несподіваними щасливими випадками приблизно кожні п'ять років. І дуже скоро ви починаєте розуміти, що видатним був Пастер, а не закони фортуни.
Сам Пастер одного разу сказав: «Удача благоволить підготовленому розуму» ( «Chance favours the prepared mind»). Кожному з нас випадає своя частка удачі, і великим стає той, хто здатний пізнати цей шанс і скористатися ним.
Пастер продовжив дослідження винних кислот і виявив, що якщо довго нагрівати d -він кислоту при певних умовах, то деякі молекули перетворюються в l-форму і виходить виноградна кислота. (З тих пір здатність змінювати оптичну активність на оптичну неактивність при нагріванні або будь-якому хімічному процесі через освіту якоїсь протилежно активної форми стали називати «рацемізації».)
Пастер також знайшов різновид винної кислоти, оптично неактивної, здатної розділятися на протилежні форми при будь-яких умовах і що володіє властивостями, відмінними від властивостей виноградної кислоти. Він назвав її мезо- винною кислотою, від грецького слова, що означає «проміжна ланка, посередник», оскільки вона здавалася проміжною ланкою між d- і l-форма кислоти.
Однак всі ці факти не могли пояснити оптичної активності розчинів. Дійсно, деякі кристали симетричні, а інші асиметричні в тій чи іншій мірі, проте в розчинах немає ніяких кристалів, а є тільки молекули.
Але чи можуть самі молекули зберігати асиметрію кристалів? Чи не є асиметрія
кристалів відображенням асиметрії складових їх молекул? Чи не є рацемізації результатом перегрупування атомів в молекулі під дією тепла? Пастер у всьому цьому не сумнівався, але не міг придумати, як довести або продемонструвати перегрупування атомів.
У 1860-х роках німецький хімік Фрідріх Август Кекуле розробив систему, в якій молекула представлялася не просто сумішшю якогось кількості атомів того чи іншого хімічного елемента, а сукупністю атомів, певним чином пов'язаних один з одним (див. Розділ 13). Маленькі рисочки між символами хімічних елементів позначали зв'язку одного атома з іншим, і молекула виглядала як дитячий конструктор.
Однак структурні формули Кекуле визнали дуже схематичними і визнали лише корисним інструментом для хіміків, які працюють з органічними речовинами і реакціями. Як і у випадку з атомами, хіміки не були готові визнати, що система Кекуле відображає дійсну ситуацію всередині молекул.
Структурні формули Кекуле дійсно пояснили існування багатьох ізомерів, оскільки продемонстрували явні відмінності в розташуванні атомів навіть при однаковій кількості атомів одного і того ж елемента в молекулі. Однак вони не пояснили особливостей тих «оптичних ізомерів», які відрізнялися тільки тим, у який бік вони повертали площину поляризованого світла.
Тепер перейдемо до голландського хіміку Якобу Гендрік Вант-Гофф, зайнятися цією проблемою в 1874 році, коли йому було всього лише двадцять два роки. Наступні міркування допоможуть зрозуміти хід його думок.
Відповідно до системи Кекуле, атом вуглецю представлений буквою С з чотирма відходять від неї маленькими зв'язками. Зазвичай ці рисочки спрямовані в кути уявного квадрата
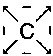
, Так що кут між двома сусідніми зв'язками становить 90 °. З'єднуючись з чотирма атомами водню, атом вуглецю утворює речовину метан, яке буде виглядати так: 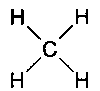
Ідентичні чи ці чотири зв'язку? Якщо кожна якимось чином відрізняється від інших, тоді що трапиться, якщо один з атомів хлору буде замість атом водню, щоб утворити метил-хлорид? Звичайно, тоді має існувати чотири різних метилхлорида, в залежності від того, до якої з чотирьох зв'язків приєднається атом хлору.
Але чотирьох різних метилхлорид не існує. Є тільки один метилхлорид і не більше того. Тобто всі чотири зв'язку хлору еквіваленти, і дійсно, раз всі чотири спрямовані в кути квадрата, цього слід було очікувати. Один кут квадрата жодним чином не відрізняється від іншого.
А тепер розглянемо випадок, коли два атома хлору заміщають атоми водню, щоб утворити метіленхлорід. Тоді, якщо ми маємо справу зі зв'язками, спрямованими в кути квадрата, має існувати два різних метиленхлорида, в залежності від того, чи розташовані атоми хлору в сусідніх або протилежних кутках квадрата:
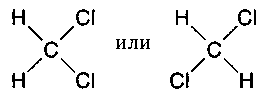
І знову нічого подібного. Існує тільки один метіленхлорід, що доводить невідповідність структурних формул Кекуле реальності (так ніхто на відповідність і не претендував).
Однією з причин такої невідповідності було те, що заради зручності всі вони малювалися двомірними - тобто на площині, - а навряд чи всі молекули в природі можуть розташовуватися строго в одній площині.
Чотири зв'язку атомів вуглецю майже напевно розподілені в трьох вимірах, і необхідно вибрати якесь тривимірне умову, за якої кожна зв'язок однаково розташована стосовно трьох інших. Тільки в цьому випадку може існувати єдиний метіленхлорід.
Найпростіший вихід з положення: направити чотири зв'язку до вершин тетраедра 8 . Тоді атом хлору немов відпочиває на трьох зв'язках, що утворюють приосадкувату триногу, а четверта зв'язок спрямована прямо вгору. І не важливо, яка з зв'язків спрямована вгору, бо три інші завжди утворюють цю приосадкувату триногу. Таким чином атом вуглецю може знаходитися в будь-який з чотирьох різних позицій і кожен раз виглядати однаково. Більш того, будь-який зв'язок одно віддалена від кожної з трьох інших. Кут між будь-якими двома зв'язками становить 109,5 °.
Якщо ми маємо справу з таким тетраедричних вуглецем, то поки дві з зв'язків прикріплені до ідентичним атомам (або групам атомів), не має значення, які атоми або групи атомів прикріплені до двох інших; в кожному випадку всі можливі компонування еквівалентні і утворюється тільки одна молекула.
Таким чином, якщо до чотирьох зв'язків атома вуглецю прикріплені аааа, або aaab, або aabb, або aabc, то не має значення, до якої зв'язку який атом прикріплений. Якщо ви з'єднаєте їх так, що утворилися дві структури здадуться вам різними, то, повертаючи першу модель так, щоб якась інша зв'язок була спрямована вгору, ви зможете зробити моделі ідентичними.
Інша справа, коли до чотирьох зв'язків прикріплені чотири різних атома або групи атомів: abcd. У цьому випадку можливі дві абсолютно різні компонування, одна з яких є дзеркальним відображенням іншої.
Атом вуглецю, до якого приєднані чотири різних атома або групи атомів, називається «асиметричним вуглецем».
Виявилося, що оптично активні органічні сполуки незмінно мають асиметричні молекули, якщо користуватися системою Вант-Гоф-фа. Майже завжди присутній, щонайменше, один асиметричний атом вуглецю. (Іноді зустрічається асиметричний атом вуглецю, а іноді асиметрична молекула, хоча всі складові її атоми вуглецю симетричні.)
У винній кислоті присутні два асиметричних атома вуглецю. Будь-хто може бути представлений в певної конфігурації або в її дзеркальному відображенні. Давайте представимо їх довільно як р і q (оскільки q є дзеркальним відображенням р). Якщо обидва атома вуглецю - рр, то ми маємо d -він кислоту, а якщо qq, то l -він кислоту.
Якщо дві половини молекули, кожна з одним асиметричним вуглецем, не ідентичні, ми отримуємо дві інші оптично активні форми: pq і qp. Однак у винної кислоти обидві половини ідентичні за структурою, так що pq і qp ідентичні і в кожному випадку оптична активність однієї половини компенсує оптичну активність іншої половини. Сумарний результат - оптично активність, і ми маємо мезо- винну кислоту.
Все це важко зрозуміти без точних структурних формул, якими я не стану вас мучити. Головне пам'ятати, що з 1874 року до цього дня всі питання оптичної активності, навіть найскладніші, задовільно пояснювалися при розгляді тетраедричного вуглецю спільно з подібними структурами для інших атомів. Хоча за минуле сторіччя наші знання про атомну структуру сильно розширилися, геометрична модель Вант-Гоффа залишилася настільки ж корисною.
Стаття Вант-Гоффа про Тетраедрічеськая атомі з'явилася в одному з голландських наукових журналів у вересні 1874 року. Два місяці по тому подібна стаття була надрукована у французькому журналі. Автором її був двадцятисемирічний французький хімік Жозеф Ашиль Ле Бель.
Обидва молодих людини працювали незалежно один від одного, так що заслуги обох рівні і зазвичай говорять про теорію Вант-Гоффа - Ле Беля.
Хіміки не відразу схвалили ідею тетраедричного атома. Зрештою все ще не було ніяких прямих доказів існування атомів (і нічого подібного не передбачалося в доступному для огляду майбутньому). Так що для деяких з найбільш древніх і консервативних хіміків нова теорія мала присмак містицизму.
У 1877 році знаменитий пятідесятідевятілетній німецький хімік Герман Кольбе виступив з різкою критикою Вант-Гоффа і його теорії. Дорікнути Кольбе нема в чому, бо нова теорія виходила далеко за рамки тодішньої хімії.
Дійсно, в науці дуже важливо піддавати нові методи здорової критики, бо цінність нової ідеї перевіряється саме її здатністю витримувати важкі удари.
Однак критику Кольбе не можна вважати справедливою. Кольбе назвав Вант-Гоффа «абсолютно невідомим хіміком», які не мають ніякого відношення до даної проблеми. І що зовсім непробачно, він висміяв Вант-Гоффа за те, що той викладав в Ветеринарної школі Утрехта, примудрившись тричі згадати про це в короткій статті і проявивши тим самим вельми непривабливу професорську чванливість.
Проте для тих, хто вважає, ніби наукові світила можуть губити корисні починання лише силою свого авторитету, консерватизмом і чванливість, слід зауважити, що ідея тетраедричного атома була сприйнята дуже активно. Вона так добре працювала, що її не могли зупинити ніякі отруйні випади Кольбе, і кар'єра Вант-Гоффа не постраждала. (Навпаки, Вант-Гофф швидко став одним з провідних світових фахівців у фізичній хімії і в 1901 році, коли були засновані Нобелівські премії, першим удостоївся Нобелівської премії з хімії.)
У наш час Кольбе найбільше відомий не завдяки власним внеском в розвиток хімії, а через різкого виступу проти Вант-Гоффа, яке часто передруковують для розваги читачів 9 .
І знову прогрес викликав нові проблеми. Як тільки була розроблена структура атома вуглецю і його зв'язків, а деталі молекул описані в трьох вимірах, виявилася цікава асиметрія в живій тканині. Це і буде темою наступного розділу.
Але яким же чином ізомери, маючи один і той же атомний склад, все ж є різними речовинами?
Може бути, важливо не тільки число атомів кожного елемента, але і їх фізичне розташування всередині молекули?
Але чи можливо, що калієво-натрієва сіль виноградної кислоти формує точно такі ж кристали, які створював Мічерліх?
Чи могла виноградна кислота наполовину бути винною кислотою, а наполовину її дзеркальним відображенням?
І стало бути, причина оптично-активності виноградної кислоти полягає в тому, що вона складається з двох частин і одна частина нейтралізує вплив іншої?
Але чи можуть самі молекули зберігати асиметрію кристалів?
Чи не є рацемізації результатом перегрупування атомів в молекулі під дією тепла?
Якщо кожна якимось чином відрізняється від інших, тоді що трапиться, якщо один з атомів хлору буде замість атом водню, щоб утворити метил-хлорид?










